MÉCANIQUE QUANTIQUE
PLAN
2. Introduction à la notion de quantum par Planck
2.1 La contribution d'Einstein
2.2. L'atome de Bohr
5. L'importance de la mécanique quantique
5.2 Résultats de la théorie quantique
Théorie qui utilise le concept d'unités discrètes pour décrire les propriétés dynamiques des particules subatomiques et les interactions entre la matière et le rayonnement. La base en fut fixée par le physicien allemand Max Planck qui affirma que la matière ainsi que l'énergie rayonnante ont une structure discontinue et, en 1900, postula que la matière ne peut émettre ou absorber l'énergie rayonnante que par petites unités discrètes appelées quanta. De même le principe d'incertitude formulé par le physicien allemand Werner Heisenberg, en 1927, fut fondamental pour le développement de la mécanique quantique ; ce principe stipule que la position et le moment d'une particule subatomique ne peuvent pas être déterminés simultanément. La théorie quantique est le fondement de toute la physique moderne.
Aux XVIIIe et XIXe siècles, la mécanique de Newton paraissait fournir une description exhaustive des mouvements des corps. Cependant, vers la fin du XIXe et le début du XXe siècle, de nouvelles observations mirent en lumière ses limites, parmi lesquelles le spectre de la lumière émise par les gaz chauffés ou dans lesquels une décharge électrique a lieu. Au début du XXe siècle, le physicien anglais Ernest Rutherford découvrit la nature des particules alpha et montra qu'elles sont constituées par des noyaux d'hélium, et énonça la loi des transformations radioactives.
Les physiciens avaient aussi à découvrir une interrelation pertinente entre les deux théories de la lumière : la théorie corpusculaire, qui présente la lumière comme un flot de particules, et la théorie ondulatoire, qui la considère comme constituée d'ondes électromagnétiques. Un troisième problème théorique consistait dans l'absence de toute base moléculaire pour la théorie thermodynamique. Dans son livre intitulé les Principes élémentaires de la mécanique statistique (Elementary Principles in Statistical Mechanics, 1902), le physicien américain Josiah Gibbs admit l'impossibilité de développer une théorie de l'action moléculaire capable d'embrasser les phénomènes de la thermodynamique, du rayonnement et les phénomènes électriques tels qu'ils étaient compris à l'époque.
Au tournant du siècle, la nature ondulatoire de la lumière semblait donc confirmée grâce à de nombreuses expérimentations. L'interférence et la diffraction avaient permis la détermination de la longueur d'onde de la lumière ; les phénomènes de polarisation avaient mis en évidence sa transversalité. La confirmation expérimentale de la théorie de Maxwell, grâce aux expériences de Hertz, indiqua qu'elle est constituée d'ondes électromagnétiques. L'interaction entre lumière et matière n'était cependant pas encore élucidée. Certains corps étant transparents, d'autres se laissant traverser seulement par des longueurs d'onde déterminées, il s'agissait d'expliquer pourquoi le spectre ne présentait pas de continuité. En 1888, Heinrich Hertz remarqua par hasard que les surfaces métalliques (une plaque de zinc, par exemple) émettent des électrons quand elles sont irradiées par des rayons ultraviolets. La libération des électrons est indépendante de l'intensité (ce fut le physicien allemand Philipp Lenard qui en apporta la preuve), mais elle augmente de manière linéaire avec la fréquence de la lumière incidente.
2. Introduction de la notion de quantum par Planck
Le premier développement qui conduisit à la résolution des difficultés théoriques que ces observations amenaient fut l'introduction par Planck de la notion de quantum comme réponse aux études conduites par les physiciens sur le rayonnement du corps noir, pendant les dernières années du XIXe siècle. (L'expression corps noir fait référence à un corps idéal, ou surface qui absorbe, sans aucune réflexion, toute l'énergie de rayonnement.) Un corps porté à une haute température (« chaleur rouge ») émet la plupart de ses rayonnements dans la gamme des basses fréquences (rouge et infrarouge) ; un corps porté à une plus haute température (« chaleur blanche ») émet relativement plus de rayonnements à de plus hautes fréquences. Dans les années 1890, les physiciens réalisèrent des études quantitatives détaillées de ces phénomènes et représentèrent les résultats sous la forme d'une série de courbes ou de graphiques. La théorie classique ou préquantique prédisait un faisceau de courbes tout à fait différentes de celles réellement observées. Le travail de Planck consista principalement à développer une formule mathématique pour décrire les courbes de façon exacte ; il en déduisit alors une hypothèse physique qui pouvait expliquer la formule. Son hypothèse indiquait que l'énergie était rayonnée seulement par quanta d'énergie hu, où u est la fréquence et h le quantum d'action, connu aujourd'hui sous le nom de constante de Planck, que nous retrouvons dans l'équation suivante :
1/2mv2 = hf - W h = 6,67.10-34Js
L'énergie cinétique mv2/2 des électrons est donc indépendante de l'intensité, mais pas de la fréquence f du rayonnement incident ; la constante de Planck h a toujours la même valeur pour tous les métaux et est donc considérée comme une constante universelle. W prend différentes valeurs suivant les matériaux, et si sa valeur est supérieure à hf, la fréquence de la lumière est insuffisante pour libérer les électrons du métal.
2.1. La contribution d'Einstein
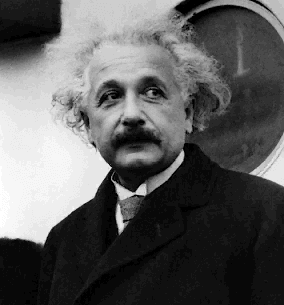
Albert Einstein expliqua les résultats obtenus par Lenard en relation avec l'effet photoélectrique (un phénomène observé expérimentalement et au cours duquel les électrons sont émis des surfaces métalliques sur lesquelles on dirige un rayonnement).
Il s'agit de l'hypothèse photonique. Einstein écrit, dans son article la Production et la génération de la lumière du point de vue heuristique (1905) : « En partant de l'hypothèse que la lumière incidente soit constituée de photons d'énergie hf, on parvient à expliquer l'émission des électrons suite à l'irradiation lumineuse de la manière suivante : les photons pénètrent dans la couche superficielle du corps et leur énergie se transforme, en partie du moins, en énergie cinétique des électrons. Le cas le plus simple est celui dans lequel un photon cède toute son énergie à un seul électron. En outre, pour quitter le corps, chaque électron doit accomplir un certain travail W, caractéristique du corps. Il s'ensuit que l'énergie cinétique des électrons sortants vaut : 1/2mv2 = hf - W. »
Cette hypothèse rencontra de vives oppositions, même de la part de Planck, et ce n'est qu'en 1921 qu'Einstein reçut le prix Nobel pour sa théorie sur l'existence des photons, laquelle eut plusieurs confirmations expérimentales.
En 1911, le physicien Rutherford détermina l'existence du noyau atomique. Se fondant sur les résultats expérimentaux obtenus par la dispersion des particules alpha de l'argent (Ag), il émit l'hypothèse que tous les atomes sont constitués d'un noyau dense chargé positivement et autour duquel tournent, comme les planètes autour du Soleil, les électrons chargés négativement. La théorie électromagnétique classique développée par le physicien britannique James Maxwell prédit sans équivoque qu'un électron tournant autour du noyau rayonne continuellement de l'énergie électromagnétique jusqu'à épuisement total de son énergie. Ainsi, d'après la théorie classique, un atome tel que décrit par Rutherford serait instable. Cette lacune amena le physicien danois Niels Bohr, à postuler, en 1913, que la théorie classique n'est pas valable pour un atome et que les électrons se déplacent sur des orbites placées à des distances déterminées du noyau et qu'à chaque changement d'orbite d'un électron il y a absorption (s'il s'éloigne du noyau) ou émission d'énergie (s'il s'en approche).
L'application de la théorie de Bohr aux atomes de plus d'un électron révèle des difficultés. Les équations mathématiques relatives au prochain atome le plus simple, celui de l'hélium, seront résolues pendant la deuxième et la troisième décade du siècle, mais les résultats ne seront pas en parfait accord avec les données expérimentales. Pour des atomes plus complexes, seules des solutions approximatives des équations sont possibles tout en ne demeurant que partiellement en accord avec les observations.
Comme les ondes électromagnétiques ont des caractéristiques de particules, le physicien français Louis Victor de Broglie suggère, en 1924, que les particules pourraient aussi, dans certains cas, montrer des propriétés d'ondes. Quelques années plus tard, cette prédiction sera vérifiée expérimentalement par les physiciens américains Clinton Joseph Davisson, Lester Halbert Germer et le britannique George Paget Thomson. Ils montrèrent qu'un faisceau d'électrons dispersés par un cristal génère une diffraction caractéristique d'une onde. La notion ondulatoire de la particule permet au physicien australien Erwin Schrödinger de développer une équation dite équation d'onde pour décrire les propriétés ondulatoires de la particule et, plus particulièrement, le comportement de l'électron dans l'atome d'hydrogène.
Quoique cette équation différentielle soit continue et ait des solutions en tous les points de l'espace, les solutions admissibles sont limitées par certaines conditions exprimées par les équations mathématiques, appelées équations caractéristiques. L'équation d'onde de Schrödinger présente donc quelques solutions discrètes seulement, ces solutions sont des expressions mathématiques dont les paramètres représentent les nombres quantiques. (Les nombres quantiques sont des entiers introduits dans la physique des particules pour exprimer la grandeur de certaines quantités caractéristiques des particules ou des systèmes.) L'équation de Schrödinger est résolue pour l'atome d'hydrogène et amène à des conclusions en accord substantiel avec la théorie quantique précédente. De plus, elle apporte une solution pour l'atome d'hélium, problème que la première théorie n'avait pas pu expliquer de façon adéquate, et demeure ici aussi en parfait accord avec les mesures expérimentales. Les solutions de l'équation de Schrödinger indiquent aussi que les quatre nombres quantiques de deux électrons ne peuvent pas être les mêmes (deux électrons ne peuvent pas occuper le même état énergétique). Cette règle, déjà établie empiriquement par le physicien suisse Wolfgang Pauli, en 1925, est appelée principe d'exclusion.
Parallèlement au développement de la mécanique ondulatoire, Heisenberg développe une nouvelle méthode d'analyse mathématique connue sous le nom de mécanique matricielle. D'après la théorie d'Heisenberg développée en collaboration avec les physiciens allemands Max Born et Ernst Pascual Jordan, cette formule n'est pas une équation différentielle mais plutôt une matrice : une zone qui consiste en un nombre infini de lignes dont chacune est constituée d'un nombre infini de grandeurs. La mécanique matricielle introduit la notion de matrices infinies pour représenter la position et le moment d'un électron à l'intérieur d'un atome. Il existe différentes matrices, pour chacune des autres propriétés physiques observables associées au mouvement d'un électron, comme l'énergie et le moment cinétique. Tout comme les équations différentielles de Schrödinger, ces équations matricielles sont solubles ; en d'autres termes, il a été possible de les manipuler pour obtenir les résultats prédits, comme par exemple les différentes fréquences des raies dans le spectre d'hydrogène et les autres grandeurs observables. À l'instar de la mécanique ondulatoire, la mécanique matricielle est en accord avec la première théorie quantique dans tous les processus pour lesquels cette dernière confirme les observations expérimentales ; elle est même utile pour expliquer les phénomènes que la première théorie quantique ne pouvait interpréter.
5. L'importance de la mécanique quantique

Par la suite, Schrödinger réussit à prouver que les mécaniques ondulatoire et matricielle sont deux versions mathématiques différentes de la même théorie, aujourd'hui appelée mécanique quantique. Même pour le simple atome d'hydrogène constitué de deux particules, les deux types d'interprétation mathématique sont extrêmement complexes. Le prochain atome le plus simple, celui d'hélium, possède trois particules ; pourtant, ce problème de trois corps (qui consiste à décrire les interactions mutuelles des trois corps séparés) n'est pas encore complètement résolu, même pas dans la dynamique classique dont l'expression mathématique est relativement simple. Il est cependant possible de calculer les niveaux d'énergie. Pour l'application de la mathématique de la mécanique quantique à des situations relativement complexes, le physicien peut utiliser l'une des nombreuses formulations. Ce choix sera déterminé par celle qui conviendra le mieux afin d'obtenir une solution approximative convenable.
Bien que la mécanique quantique décrive les phénomènes observés en termes purement mathématiques, il est possible de donner une description grossière de ce que l'atome est censé être aujourd'hui. Une série d'ondes stationnaires entourent le noyau ; ces ondes ont des sommets en certains points ; chaque onde stationnaire complète représente une orbite. La valeur absolue du carré de l'amplitude de l'onde en un point de l'espace à un moment donné est la probabilité d'y trouver l'électron. Ainsi apparaît désormais l'impossibilité de prédire la présence d'un électron en un point précis à un moment donné (principe d'incertitude).
5.1. Le principe d'incertitude

L'impossibilité de localiser un électron avec exactitude à un moment précis est analysée par Werner Heisenberg qui, en 1927, formule le principe d'incertitude. Ce principe stipule l'impossibilité de déterminer simultanément la position exacte et le moment d'une particule. En premier lieu, il est impossible de mesurer la position d'une particule sans perturber sa vitesse. Les connaissances de la position et de la vitesse sont dites complémentaires, c'est-à-dire qu'elles ne peuvent pas être précisées simultanément. Ce principe est aussi fondamental si l'on veut comprendre la mécanique quantique telle qu'elle est conçue aujourd'hui : les caractères ondulatoire et corpusculaire du rayonnement électromagnétique peuvent être compris comme deux propriétés complémentaires du rayonnement.
5.2 Résultats de la théorie quantique
La mécanique quantique a résolu tous les problèmes importants ayant agité le monde de la physique au début des années 1920. Elle a continuellement amélioré la compréhension de la structure de la matière et fourni une base théorique nécessaire à la compréhension de la structure de l'atome et des phénomènes des raies spectrales : chaque raie du spectre correspond à l'énergie d'un photon transmise ou absorbée lorsqu'un électron passe d'un niveau d'énergie à un autre. L'interprétation des liaisons chimiques a été radicalement transformée par la mécanique quantique et est désormais fondée sur les équations d'onde de Schrödinger. En physique, de nouveaux domaines voient le jour : la physique du solide, la physique de la matière condensée, la supraconductivité, la physique nucléaire et la physique des particules élémentaires qui trouvent toutes en la mécanique quantique une base cohérente.
Depuis 1925, aucun déficit essentiel n'a été découvert dans la mécanique quantique ; pourtant la question de savoir si cette théorie doit être considéréecomme complète a été soulevée. Dans les années 1930, l'application de la mécanique quantique et d'une relativité spéciale sur la théorie de l'électron permettent au physicien britannique Paul Dirac de formuler une équation qui sous-entend l'existence du spin de l'électron. Par la suite, cette équation conduira à la découverte de l'existence du positron par le physicien américain Carl David Anderson.
L'application de la mécanique quantique au domaine du rayonnement électromagnétique permet d'expliquer beaucoup de phénomènes tels que le rayonnement de freinage (rayonnement émis par les électrons freinés dans la matière) et la formation de paires (formation d'un positron et d'un électron suite à l'interaction entre l'énergie électromagnétique et la matière). Néanmoins, elle soulève un problème grave appelé difficulté de divergence : certains paramètres, comme la masse simple et la charge simple de l'électron, semblent être infiniment grands dans les équations de Dirac. (Les expressions masse simple et charge simple se réfèrent à des électrons hypothétiques n'ayant d'interaction avec aucune matière et aucun rayonnement ; en réalité, les électrons ont toujours une interaction, ne serait-ce qu'avec leur propre champ électrique.) Ce problème est résolu partiellement en 1947-1949 dans le cadre d'un programme nommé renormalisation, développé par le physicien japonais Shin'ichiro Tomonaga, les physiciens américains Julian S. Schwinger et Richard Feynman et le physicien américain d'origine britannique Freeman Dyson. Dans ce programme, la masse et la charge simples de l'électron sont infiniment grandes, de sorte que les autres grandeurs physiques infinies de l'équation sont négligeables. La renormalisation a permis d'augmenter considérablement la précision avec laquelle la structure de l'atome peut être analysée.
La mécanique quantique sert de base aux tentatives actuelles visant à expliquer la force nucléaire et à développer une théorie unifiée pour toutes les interactions fondamentales de la matière. Toutefois, il existe encore des doutes sur l'intégralité de la théorie quantique. La difficulté de divergence, par exemple, n'est que partiellement résolue. Au moment où la mécanique de Newton est rectifiée par la quantique et la relativité, plusieurs scientifiques (dont Einstein) prédirent de profonds changements dans la mécanique quantique. De grosses difficultés d'ordre théorique persistent par exemple entre la mécanique quantique et la théorie du chaos, qui connut un essor rapide dès les années 1980. Des efforts visant à développer un système capable de concilier la relativité et la mécanique quantique sont actuellement déployés par des théoriciens tels que le physicien britannique Stephen Hawking.